MEMANIPULASI GUGUS FUNGSI PADA OKSIDASI REDUKSI
A. PENGERTIAN REDUKSI OKSIDASI
Oksidasi Adalah peristiwa pelepasan elektron, baik melibatkan oksigen ataupun tidak.
Contoh oksidasi :
Oksidasi Adalah peristiwa pelepasan elektron, baik melibatkan oksigen ataupun tidak.
Contoh oksidasi :
- Yang melibatkan oksigen :
2. Yang tidak melibatkan oksigen :
Mg + 2HCl → MgCl2 + H2 loncatan elektronnya Mg → Mg + 2e
Reduksi Adalah peristiwa pendapatan elektron, baik melibatkan oksigen ataupun tidak.
Contoh reduksi :
Reduksi Adalah peristiwa pendapatan elektron, baik melibatkan oksigen ataupun tidak.
Contoh reduksi :
- Yang melibatkan oksigen :
2. Yang tidak melibatkan oksigen :
Fe + 1e → Fe
Fe + 1e → Fe
Reaksi Redoks Adalah reaksi yang dimana terjadi peristiwa oksidasi dan reduksi.
Contoh reaksi redoks : 2Ag2O → 4Ag + O2
Contoh reaksi redoks : 2Ag2O → 4Ag + O2
Reduksi : 4 Ag + 4e → 4 Ag
Oksidasi : 2O → O2 + 4e +
Redoks : 4Ag + 2O → 4 Ag + O2
Oksidasi : 2O → O2 + 4e +
Redoks : 4Ag + 2O → 4 Ag + O2
Aldehid dan keton sama-sama mempunyai gugus karbonil (C=O). Dengan demikian, sifat fisika dan kimia keduanya hampir sama. Aldehid dan keton dapat dikenai reaksi reduksi maupun oksidasi, dan menghasilkan senyawa organik golongan lain.
Reaksi oksidasi terhadap aldehid menggunakan reagen oksidator yang bervariasi akan menghasilkan asam karboksilat. Oksidator yang paling umum digunakan untuk aldehid adalah kalium dikromat. Aldehid juga dapat teroksidasi menjadi asam karboksilat oleh oksigen bebas di udara.
Oksidasi senyawa organik merupakan keadaan terjadinya pembentukan ikatan antara karbon dan atom yang lebih elektronegatif (biasanya O, N, atau halogen) atau dengan pemutusan ikatan antara karbon dan atom kurang elektronegatif (biasanya H) sehingga dapat menghilangkan kerapatan elektron pada karbon. Sebaliknya, reduksi organik menghasilkan penguatan kerapatan elektron pada karbon yang disebabkan oleh pembentukan ikatan antara karbon dan atom yang kurang elektronegatif atau dengan pemutusan ikatan antara karbon dan atom yang lebih elektronegatif.
Senyawa golongan keton sukar dioksidasi menggunakan oksidator apapun, termasuk kalium dikromat dan oksigen molekuler. Aldehida mudah dioksidasi sedangkan keton tidak bisa dioksidasi
Aldehida direduksi menghasilkan alkohol primer, sedangkan keton menghasilkan alkohol sekunder.
Reduksi ikatan rangkap C=O lebih sulit direduksi daripada ikatan rangkap C=C. Dengan demikian, jika suatu senyawa mengandung gugus C=O dan C=C dikenai reaksi reduksi, maka C=C akan tereduksi terlebih dahulu.
B. SEJARAH PERKEMBANGAN TEORI REDOKS
Sebelum melangkah lebih jauh tentang reaksi redoks sebaiknya kita mengetahui terlebih
dahulu bagaimana sejarah perkembangan hingga timbulnya teori redoks.
Dari beberapa abad sebelum Masehi, orang telah mengenal api, terutama pada peristiwa
pembakaran. Sejak saat itu para ahli pengetahuan mulai tertarik tentang proses pembakaran.
Kemudian pada abad ke-16, melalui eksperiment Boyle mengemukakan bahwa pada pembakaan
terjadi penggabungan antara benda yang dibakar dengan partikel api.
Abad ke-17, George Stahl mengemukakan bahwa apabila benda dibakar, maka benda itu akan
kehilangan sesuatu yang disebut plongiston, sehingga apabila benda terbakar massanya
bertambah. Teori ini berlaku untuk logam-logam, tetapi untuk batu bara tidak. Batu bara
apabila dibakar, massa arang yang terbentuk berkurang. Oleh karena itulah pada tahun 1772,
Lavoiser meneliti peristiwa pembakaran bermacam-macam logam dengan udara. Lavoisier
mengatakan bahwa bertambahnya berat logam bila dibakar dalam udara disebabkan karena
adanya reaksi antara logam tersebut dengan gas yang ada di udara, oksigen. Selanjutnya
ahli-ahli kimia mulai mengklasifikasikan reaksi suatu zat dengan oksigen dan diberi
istilah reaksi oksidasi.
1. Konsep Dasar Reaksi Redoks
Reaksi kimia dapat digolongkan ke dalam reaksi redoks dan reaksi bukan redoks. Reaksi
redoks adalah reaksi yang berkaitan dengan peristiwa reduksi dan oksidasi. Reaksi redoks
banyak terjadi dalam kehidupan sehari-hari, misalnya perkaratan besi, reaksi-reaksi
pembakaran, oksidasi makanan dalam sel, fotosintesis, dan peleburan bijih logam, aki,
baterai, dan berbagai proses elektrolisis seperti penyepuhan. Dalam mempelajari reaksi
redoks ada beberapa konsep dasar yang harus dipahami, seperti :
a. Oksidasi :
-Penambahan/pengikatan atom oksigen
-Pelepasan Elektron
-Naiknya bilangan oksidasi
b. Reduksi
-Pengurangan atom oksigen
-Penambahan Elektron
-Turunnya bilangan oksidasi
c. Reduktor (Pereduksi)
-Zat yang mengalami oksidasi
d. Oksidator (pengoksidasi)
-Zat yang mengalami reduksi
e. Reaksi Redoks
-Reaksi yang mengandung peristiwa reduksi dan oksidasi
f. Reaksi autoredoks (disproporsionasi)
-Reaksi redoks yang oksidator dan reduktornya merupakan zat yang sama
g. Bilangan oksidasi
-Muatan suatu atom jika elektron ikatan diberikan kepada atom yang keelektronegatifannya
lebih besar.
2. Perkembangan konsep Redoks
Pengertian reaksi reduksi dan oksidasi telah mengalami berbagai perkembangan. Pada awalnya
peristiwa reduksi oksidasi dikaitkan dengan pelepasan dan pengikatan oksigen. Pada
perkembangan selanjutnya oksidasi dan reduksi dikaitkan dengan penangkapan dan pelepasan
elektron, dan kemudian dengan perubahan bilangan oksidasi. Hal ini dimaksudkan untuk
memberikan cakupan yang lebih luas bagi jenis reaksi tersebut.
C. REDOKS BERDASARKAN PELEPASAN DAN PENERIMAAN ELEKTRON
Reaksi antara unsur logam dan non logam terjadi dengan serah terima elektron. Perhatikan
contoh berikut:
1. Reaksi kalsium dengan oksigen
2. Reaksi kalsium dengan belerang
Menurut konsep oksidasi reduksi terdahulu, reaksi (1) merupakan reaksi oksidasi karena
merupakan pengikatan oksigen, tetapi reaksi(2) tidak termasuk oksidasi. Pada hal, dalam
kedua reaksi itu kalsium mengalami hal yang sama yaitu: melepas 2 elektron. Sehingga
pengertian redoks terlalu sempit jika hanya ditinjau dari pengikatan dan pelepasan
oksigen. Oleh karena itu muncullah konsep reduksi oksidasi berdasarkan serah terima
elektron. Oksidasi adalah reaksi pelepasan elektron, sedangkan reduksi adalah reaksi
pengikatan/penyerapan elektron.
Pada reaksi (2) di atas kalsium mengalami oksidasi karena melepas elektron, sedangkan
belerang mengalami reduksi karena menangkap elektron. Reaksi yang melibatkan oksidasi
reduksi selanjutnya kita sebut reaksi redoks (reduksi-oksidasi) Sedangkan reaksi yang
hanya reduksi atau oksidasi saja disebut setengah reaksi.
Contoh :
1. 2Cu + O2 → 2CuO
2Cu → 2Cu2+ + 4e (Oksidasi)
O2 + 4e → 2O2- (Reduksi)
2Cu + O2 → 2CuO (Redoks)
2. Cu + Cl2 CuCl2
Cu → Cu2+ + 2e (Oksidasi)
Cl2 + 2e → 2Cl- (Reduksi)
Cu + Cl2 → CuCl2 (Redoks)
Oksidator adalah zat yang menangkap elektron dan mengalami reduksi, sedangkan reduktor
adalah zat yang melepas elektron dan mengalami oksidasi. Pada contoh diatas, kalsium
dioksidasi oleh belerang. Oleh karena itu belerang merupakan pengoksidasi atau oksidator.
Belerang direduksi oleh kalsium, sehingga kalsium merupakan pereduksi atau reduktor.
Pengikatan Oksigen :
Senyawa yang terbentuk dari hasil reaksi dengan oksigen dinamakan oksida sehingga reaksi antara oksigen dan suatu unsur dinamakan reaksi oksidasi. Karat besi adalah senyawa yang terbentuk dari hasil reaksi antara besi dan oksigen (besi oksida). Perkaratan besi merupakan salah satu contoh dari reaksi oksidasi. Persamaan reaksi pembentukan oksida besi dapat ditulis sebagai berikut.
Pada reaksi tersebut, besi mengalami oksidasi dengan cara mengikat oksigen menjadi besi oksida. Kebalikan dari reaksi oksidasi dinamakan reaksi reduksi. Pada reaksi reduksi terjadi pelepasan oksigen. Besi oksida dapat direduksi dengan cara direaksikan dengan gas hidrogen, persamaan reaksinya:
Pelepasan dan Penerimaan Elektron
Dalam konsep redoks, peristiwa pelepasan elektron dinamakan oksidasi, sedangkan peristiwa penerimaan elektron dinamakan reduksi. Reaksi redoks pada peristiwa perkaratan besi dapat dijelaskan dengan reaksi berikut:
Contoh Reaksi Reduksi Oksidasi berdasarkan Transfer elektron
 Dari persamaan tersebut, dapat diketahui bahwa Mg melepaskan elektron dan Cl menerima elektron. Dengan demikian, Mg mengalami oksidasi dan Cl mengalami reduksi.
Dari persamaan tersebut, dapat diketahui bahwa Mg melepaskan elektron dan Cl menerima elektron. Dengan demikian, Mg mengalami oksidasi dan Cl mengalami reduksi.
Reduktor dan Oksidator
Dalam reaksi redoks, pereaksi yang dapat mengoksidasi pereaksi lain dinamakan zat pengoksidasi atau oksidator. Sebaliknya, zat yang dapat mereduksi zat lain dinamakan zat pereduksi atau reduktor. Pada Contoh diatas, Magnesium melepaskan elektron yang menyebabkan klorin mengalami reduksi. Dalam hal ini, magnesium disebut zat pereduksi atau reduktor. Sebaliknya, atom klorin berperan dalam mengoksidasi magnesium sehingga klorin disebut oksidator.
Contoh Reduktor dan Oksidator
Reaksi Redoks Berdasarkan Perubahan Bilangan Oksidasi
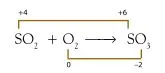
Bagaimana bilangan oksidasi dapat menjelaskan reaksi redoks? Apa Anda cukup puas dengan konsep transfer elektron? Tinjau antara reaksi SO2 dengan O2 membentuk SO3. Reaksinya dapat dituliskan sebagai berikut :
Jika dikaji berdasarkan konsep pengikatan oksigen maka reaksi tersebut adalah reaksi oksidasi. Jika dikaji berdasarkan transfer elektron maka Anda mungkin akan bingung, mengapa? Pada reaksi tersebut tidak terjadi transfer elektron, tetapi terjadi penggunaan bersama pasangan elektron membentuk ikatan kovalen. Reaksi tersebut tidak dapat dijelaskan dengan konsep transfer elektron.
Oleh karena banyak reaksi redoks yang tidak dapat dijelaskan dengan konsep pengikatan oksigen maupun transfer elektron maka para pakar kimia mengembangkan konsep alternatif, yaitu perubahan bilangan oksidasi. Menurut konsep ini, jika dalam reaksi bilangan oksidasi atom meningkat maka atom tersebut mengalami oksidasi. Sebaliknya, jika bilangan oksidasinya turun maka atom tersebut mengalami reduksi.
Untuk mengetahui suatu reaksi tergolong reaksi redoks atau bukan menurut konsep perubahan bilangan oksidasi maka perlu diketahui biloks dari setiap atom, baik dalam pereaksi maupun hasil reaksi.
Berdasarkan diagram tersebut dapat disimpulkan bahwa:
Atom S mengalami kenaikan biloks dari +4 menjadi +6, peristiwa ini disebut oksidasi; atom O mengalami penurunan biloks dari 0 menjadi –2, peristiwa ini disebut reduksi. Dengan demikian, reaksi tersebut adalah reaksi redoks.
Oleh karena molekul O2 menyebabkan molekul SO2 teroksidasi maka molekul O2 adalah oksidator. Molekul O2 sendiri mengalami reduksi akibat molekul SO2 sehingga SO2 disebut reduktor.
Contoh Reaksi Redoks Menurut Perubahan Bilangan Oksidasi

Permasalahan :

Permasalahan :
- Seperti yang sudah dibahas bahwa Senyawa golongan keton sukar dioksidasi menggunakan oksidator apapun, termasuk kalium dikromat dan oksigen molekuler. Mengapa demikian?
- bagaimana caranya agar kita dapat mengetahui suatu reaksi tergolong reaksi redoks atau bukan menurut konsep perubahan bilangan oksidasi?


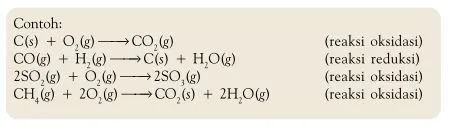


Saya akan menjawab permasalahan yg pertama
ReplyDeleteAldehida dan keton sama-sama mempunyai gugus karbonil. Dengan demikian, sifat fisika dan kimia aldehida dan keton hampir sama. Aldehida dan keton dapat dikenai reaksi reduksi maupun oksidasi, dan menghasilkan senyawa organik golongan lain.oksigen molekuler. Aldehida mudah dioksidasi sedangkan keton tidak bisa dioksidasi. Perbedaan kedua golongan senyawa ini secara sederhana dapat diketahui melalui suatu uji.
Untuk menentukan suatu zat apakah aldehida atau keton, dapat dilakukan langkah pengujian dengan oksidator ringan. Jika dapat dioksidasi, maka senyawa tersebut adalah aldehida, sedangkan jika tidak maka senyawa tersebut pasti golongan keton
Saya akan menjawab permasalahan kedua Dalam konsep redoks, peristiwa pelepasan elektron dinamakan oksidasi, sedangkan peristiwa penerimaan elektron dinamakan reduksi. Reaksi redoks pada peristiwa perkaratan besi dapat dijelaskan dengan reaksi berikut:
DeletePada reaksi tersebut, enam elektron dilepaskan oleh dua atom besi dan diterima oleh tiga atom oksigen membentuk senyawa Fe2O3, Oleh karena itu, peristiwa oksidasi selalu disertai peristiwa reduksi
Saya akan menjawab permasalahan no 2. Bagaimana caranya agar kita dapat mengetahui suatu reaksi tergolong reaksi redoks atau bukan menurut konsep perubahan bilangan oksidasi?
ReplyDeleteBilangan oksidasi adalah muatan listrik yang seakan-akan dimiliki oleh unsur dalam suatu senyawa atau ion. Setelah memahami cara menentukan bilangan oksidasi suatu atom, kita dapat menentukan reaksi oksidasi reduksi berdasarkan perubahan bilangan oksidasi.
menurut konsep perubahan bilangan oksidasi maka perlu diketahui biloks dari setiap atom, baik dalam pereaksi maupun hasil reaksi.
Saya akan mencoba menjawab permasalahan ke 2. Oleh karena banyak reaksi redoks yang tidak dapat dijelaskan dengan konsep pengikatan oksigen maupun transfer elektron maka para pakar kimia mengembangkan konsep alternatif, yaitu perubahan bilangan oksidasi. Menurut konsep ini, jika dalam reaksi bilangan oksidasi atom meningkat maka atom tersebut mengalami oksidasi. Sebaliknya, jika bilangan oksidasinya turun maka atom tersebut mengalami reduksi.
ReplyDeleteBerdasarkan konsep bilangan oksidasi, apakah reaksi SO2 dan O2 merupakan reaksi redoks? Untuk mengetahui suatu reaksi tergolong reaksi redoks atau bukan menurut konsep perubahan bilangan oksidasi maka perlu diketahui biloks dari setiap atom, baik dalam pereaksi maupun hasil reaksi. Biloks dari SO2, O2, dan SO3 adalah 0 (aturan d). Biloks O dalam SO2 dan SO3 = –2 (aturan c.3) maka biloks S dalam SO2 = +4 dan biloks S dalam SO3 = +6. Berdasarkan perhitungan tersebut dapat disimpulkan bahwa:
a) atom S mengalami kenaikan biloks dari +4 menjadi +6, peristiwa ini disebut oksidasi;
b) atom O mengalami penurunan biloks dari 0 menjadi –2, peristiwa ini disebut reduksi. Dengan demikian, reaksi tersebut adalah reaksi redoks. Manakah reduktor dan oksidator pada reaksi di atas? Oleh karena molekul O2 menyebabkan molekul SO2 teroksidasi maka molekul O2 adalah oksidator. Molekul O2 sendiri mengalami reduksi akibat molekul SO2 sehingga SO2 disebut reduktor.
saya akan mencoba menjwab permasalhan 2
ReplyDeleteSenyawa yang terbentuk dari hasil reaksi dengan oksigen dinamakan oksida sehingga reaksi antara oksigen dan suatu unsur dinamakan reaksi oksidasi. Karat besi adalah senyawa yang terbentuk dari hasil reaksi antara besi dan oksigen (besi oksida). Perkaratan besi merupakan salah satu contoh dari reaksi oksidasi. Persamaan reaksi pembentukan oksida besi dapat ditulis sebagai berikut.
Pada reaksi tersebut, besi mengalami oksidasi dengan cara mengikat oksigen menjadi besi oksida. Kebalikan dari reaksi oksidasi dinamakan reaksi reduksi. Pada reaksi reduksi terjadi pelepasan oksigen. Besi oksida dapat direduksi dengan cara direaksikan dengan gas hidrogen, persamaan reaksinya:
2
ReplyDeleteBerdasarkan konsep bilangan oksidasi, apakah reaksi SO2 dan O2 merupakan reaksi redoks? Untuk mengetahui suatu reaksi tergolong reaksi redoks atau bukan menurut konsep perubahan bilangan oksidasi maka perlu diketahui biloks dari setiap atom, baik dalam pereaksi maupun hasil reaksi. Biloks dari SO2, O2, dan SO3 adalah 0 (aturan d). Biloks O dalam SO2 dan SO3 = –2 (aturan c.3) maka biloks S dalam SO2 = +4 dan biloks S dalam SO3 = +6. Berdasarkan perhitungan tersebut dapat disimpulkan bahwa:
a) atom S mengalami kenaikan biloks dari +4 menjadi +6, peristiwa ini disebut oksidasi;
b) atom O mengalami penurunan biloks dari 0 menjadi –2, peristiwa ini disebut reduksi. Dengan demikian, reaksi tersebut adalah reaksi redoks. Manakah reduktor dan oksidator pada reaksi di atas? Oleh karena molekul O2 menyebabkan molekul SO2 teroksidasi maka molekul O2 adalah oksidator. Molekul O2 sendiri mengalami reduksi akibat molekul SO2 sehingga SO2 disebut reduktor.
Saya akan mencoba menjawab permasalahan Anda yg ke-1:
ReplyDeleteUntuk menentukan suatu zat apakah aldehida atau keton, dapat dilakukan langkah pengujian dengan oksidator ringan. Jika dapat dioksidasi, maka senyawa tersebut adalah aldehida, sedangkan jika tidak maka senyawa tersebut pasti golongan keton
ReplyDeleteAldehida dan keton sama-sama mempunyai gugus karbonil. Dengan demikian, sifat fisika dan kimia aldehida dan keton hampir sama. Aldehida dan keton dapat dikenai reaksi reduksi maupun oksidasi, dan menghasilkan senyawa organik golongan lain.oksigen molekuler. Aldehida mudah dioksidasi sedangkan keton tidak bisa dioksidasi. Perbedaan kedua golongan senyawa ini secara sederhana dapat diketahui melalui suatu uji.
Untuk menentukan suatu zat apakah aldehida atau keton, dapat dilakukan langkah pengujian dengan oksidator ringan. Jika dapat dioksidasi, maka senyawa tersebut adalah aldehida, sedangkan jika tidak maka senyawa tersebut pasti golongan keton
REPLY
Enda damanikSeptember 15, 2018 at 6:54 AM
Saya akan menjawab permasalahan kedua Dalam konsep redoks, peristiwa pelepasan elektron dinamakan oksidasi, sedangkan peristiwa penerimaan elektron dinamakan reduksi. Reaksi redoks pada peristiwa perkaratan besi dapat dijelaskan dengan reaksi berikut:
Pada reaksi tersebut, enam elektron dilepaskan oleh dua atom besi dan diterima oleh tiga atom oksigen membentuk senyawa Fe2O3, Oleh karena itu, peristiwa oksidasi selalu disertai peristiwa reduksi
Nadya AngraeniSeptember 15, 2018 at 7:03 AM
Saya akan menjawab permasalahan no 2. Bagaimana caranya agar kita dapat mengetahui suatu reaksi tergolong reaksi redoks atau bukan menurut konsep perubahan bilangan oksidasi?
Bilangan oksidasi adalah muatan listrik yang seakan-akan dimiliki oleh unsur dalam suatu senyawa atau ion. Setelah memahami cara menentukan bilangan oksidasi suatu atom, kita dapat menentukan reaksi oksidasi reduksi berdasarkan perubahan bilangan oksidasi.
menurut konsep perubahan bilangan oksidasi maka perlu diketahui biloks dari setiap atom, baik dalam pereaksi maupun hasil reaksi.
Saya akan menjawab permasalahan no 2. Bagaimana caranya agar kita dapat mengetahui suatu reaksi tergolong reaksi redoks atau bukan menurut konsep perubahan bilangan oksidasi?
ReplyDeleteBilangan oksidasi adalah muatan listrik yang seakan-akan dimiliki oleh unsur dalam suatu senyawa atau ion. Setelah memahami cara menentukan bilangan oksidasi suatu atom, kita dapat menentukan reaksi oksidasi reduksi berdasarkan perubahan bilangan oksidasi
saya akan mencoba menjwab permasalhan 2
ReplyDeleteSenyawa yang terbentuk dari hasil reaksi dengan oksigen dinamakan oksida sehingga reaksi antara oksigen dan suatu unsur dinamakan reaksi oksidasi. Karat besi adalah senyawa yang terbentuk dari hasil reaksi antara besi dan oksigen (besi oksida). Perkaratan besi merupakan salah satu contoh dari reaksi oksidasi. Persamaan reaksi pembentukan oksida besi dapat ditulis sebagai berikut.
Pada reaksi tersebut, besi mengalami oksidasi dengan cara mengikat oksigen menjadi besi oksida. Kebalikan dari reaksi oksidasi dinamakan reaksi reduksi. Pada reaksi reduksi terjadi pelepasan oksigen. Besi oksida dapat direduksi dengan cara direaksikan dengan gas hidrogen, persamaan reaksinya:
Saya akan menjawab permasalahan yg pertama
ReplyDeleteAldehida dan keton sama-sama mempunyai gugus karbonil. Dengan demikian, sifat fisika dan kimia aldehida dan keton hampir sama. Aldehida dan keton dapat dikenai reaksi reduksi maupun oksidasi, dan menghasilkan senyawa organik golongan lain.oksigen molekuler. Aldehida mudah dioksidasi sedangkan keton tidak bisa dioksidasi. Perbedaan kedua golongan senyawa ini secara sederhana dapat diketahui melalui suatu uji.
Untuk menentukan suatu zat apakah aldehida atau keton, dapat dilakukan langkah pengujian dengan oksidator ringan. Jika dapat dioksidasi, maka senyawa tersebut adalah aldehida, sedangkan jika tidak maka senyawa tersebut pasti golongan keton
Nomor 2
ReplyDeleteDalam konsep redoks, peristiwa pelepasan elektron dinamakan oksidasi, sedangkan peristiwa penerimaan elektron dinamakan reduksi. Reaksi redoks pada peristiwa perkaratan besi dapat dijelaskan dengan reaksi berikut:
Pada reaksi tersebut, enam elektron dilepaskan oleh dua atom besi dan diterima oleh tiga atom oksigen membentuk senyawa Fe2O3, Oleh karena itu, peristiwa oksidasi selalu disertai peristiwa reduksi
No 2 Oleh karena banyak reaksi redoks yang tidak dapat dijelaskan dengan konsep pengikatan oksigen maupun transfer elektron maka para pakar kimia mengembangkan konsep alternatif, yaitu perubahan bilangan oksidasi. Menurut konsep ini, jika dalam reaksi bilangan oksidasi atom meningkat maka atom tersebut mengalami oksidasi. Sebaliknya, jika bilangan oksidasinya turun maka atom tersebut mengalami reduksi.
ReplyDeleteSaya akan menjawab permasalahan kedua Dalam konsep redoks, peristiwa pelepasan elektron dinamakan oksidasi, sedangkan peristiwa penerimaan elektron dinamakan reduksi. Reaksi redoks pada peristiwa perkaratan besi dapat dijelaskan dengan reaksi berikut:
ReplyDeletePada reaksi tersebut, enam elektron dilepaskan oleh dua atom besi dan diterima oleh tiga atom oksigen membentuk senyawa Fe2O3, Oleh karena itu, peristiwa oksidasi selalu disertai peristiwa reduksi.