REAKSI ADISI ORGANOMETALIK PADA SENYAWA KARBONIL
A. Pengertian Kimia Organologam

Kimia organologam
adalah studi mengenai senyawa kimia yang mengandung ikatan antara karbon dan logam. Istilah "logam" dalam konteks ini diartikan secara luas mencakup unsur-unsur seperti silikon atau boron, yang sebenarnya bukan logam (metaloid. Kimia organologam menggabungkan aspek-aspek kimia anorganik dengan kimia organik. Senyawaan organologam banyak ditemukan dalam kehidupan sehari-hari sebagai katalis, misalnya pada pengolahan hasil minyak bumi dan produksi polimer organik.
Kimia organologam adalah ilmu kimia yang mempelajari tentang logam yang berikatan langsung dengan satu atau lebih atom carbon. Beberapa senyawa organologam ada yang tidak berikatan lansung dengan atom karbon seperti pada kompleks phospine, logam hidrida, organosilikon, organoboron dan lainnya. Ada beberapa logam yang berikatan langsung dengan unsur karbonnya namun bukan termasuk senyawa organologam, yaitu logam karbida dan logam sianida. Fungsi utama senyawa organologam adalah sebagai katalis pada reaksi kimia.
1. Senyawa Organometalik (Organologam)
Senyawa organologam merupakan senyawa yang mengandung ikatan karbon dengan logam (logam yang langsung terikat pada atom C yang membuat atom C bermuatan negatif / karbanion). Atom logam (seperti Hg, Zn, Pb, Mg dan Li) atau ke metaloid-metaloid tertentu (seperti Si, As dan Se). Cabang ilmu kimia yang mempelajari tentang ikatan antara senyawa organic (mengandung atom Carbon) dan anorganik (logam) yaitu organologam. Organologam sangat erat kaitannya dengan logam-logam yang terikat dengan Carbon. Tetapi perlu diketahui bahwa senyawa organologam sangat kompleks susunannya. Senyawa organologam merupakan senyawa yang terbentuk dari atom logam dan gugus organik dimana atom-atom karbon dari gugus organiknya terikat pada atom logam. Sifat senyawa organologam yang umum ialah atom karbon yang lebih elektronegatif daripada kebanyakan logamnya. Senyawa kompleks logam (biasanya logam-logam transisi) merupakan senyawa yang memiliki satu atau lebih ikatan logam-karbon. Senyawa ini terdiri dari atom pusat dan ligan (Blaser et al , 2000)
Reaksi yang terjadi pada senyawa organologam bisa dibilang sangat kompleks Karena melibatkan reaksi-reaksi ligan organik dan bagaimana ligan tersebut berikatan dengan atom logam. Aplikasi senyawa organologam yang mungkin paling menonjol adalah sebagai katalis. Sebagai contoh apabila kita memiliki senyawa organik A dan B, dimana kita berkeinginan untuk menggabungkan rantai karbon milik A dan B. Agar kedua senyawa tersebut dapat bergabung maka dibutuhkanlah suatu katalis organologam dimana dia akan melakukan berbagai macam reaksi sampai senyawa A dan B bisa bergabung dan katalis itu sendiri akan melepaskan diri.
Senyawa organologam adalah senyawa di mana atom-atom karbon dari gugus organik terikat kepada atom logam. Contoh, suatu aloksida seperti (C3H7O)4Ti tidaklah dianggap sebagai suatu senyawa organologam karena gugus organiknya terikat pada Ti melalui oksigen, sedangkan C6H5Ti(OC3H7)3 karena terdapat satu ikatan langsung antara karbon C dari gugus fenil dengan logam Ti.HH Istilah organologam biasanya didefenisikan agak longgar, dan senyawaan dari unsur-unsur seperti Boron, fosfor, dan silikon semuanya mirip logam. Tetapi untuk senyawa yang mengandung ikatan antara atom logam dengan oksigen, belerang, nitrogen, ataupun dengan suatu halogen tidak termasuk sebagai senyawa organologam. Dari bentuk ikatan pada senyawa organologam, senyawa ini dapat dikatakan sebagai jembatan antara kimia organik dan anorganik.
Sifat senyawa organologam yang umum ialah atom karbon yang lebih elektronegatif daripada kebanyakan logamnya. Senyawa komplek logam (biasanya logam-logam transisi) merupakan senyawa yang memiliki satu atau lebih ikatan logam-karbon. Senyawa organologam terdiri dari atom pusat dan ligan.
Terdapat beberapa kecenderungan jenis-jenis ikatan yang terbentuk pada senyawaan organologam:
a. Senyawaan ionik dari logam elektropositif
Garam logam ion-ion karbon yang kestabilannya diperkuat oleh delokalisasi elektron lebih stabil walaupun masih relatif reaktif. Adapun contoh gugus organik dalam garam-garaman tersebut seperti (C6H5)3C-Na+ dan (C5H5)2Ca2+.
b. senyawa yang memiliki ikatan -σ (sigma)
Senyawaan organologam dimana sisa organiknya terikat pada suatu atom logam dengan suatu ikatan yang digolongkan sebagai ikatan kovalen (walaupun masih ada karakter-karakter ionik dari senyawaan ini) yang dibentuk oleh kebanyakan logam dengan keelektropositifan yang relatif lebih rendah dari golongan pertama di atas,
Pada dasarnya Organologam prinsipnya yaitu atom-atom Karbon dari gugus organik terikat kepada atom logam. Konsep ini yang mendasari Organologam, sehingga banyak cara untuk menghasilkan ikatan-ikatan logam pada Carbon yang berguna bagi kedua logam transisi dan non-transisi. Beberapa yang lebih penting adalah sebagai berikut:
- Reaksi Logam langsung ; sintesis yang paling awal oleh ahli kimia Inggris, Frankland dalam tahun 1845 adalah interaksi antara Zn dan suatu alkil Halida. Adapun yang lebih berguna adalah penemuan ahli kimia Perancis, Grignard yang dikenal sebagai pereaksi Grignard. Contohnya interaksi Magnesium dan alkil atau aril Halida dalam eter:
Mg + CH3I → CH3MgI
Interaksi langsung alkil atau aril Halida juga terjadi dengan Li, Na, K, Ca, Zn dan Cd.
- Penggunaan zat pengalkilasi. Senyawa ini dimanfaatkan untuk membuat senyawa organologam lainnya. Kebanyakan Halida nonlogam dan logam atau turunan Halida dapat dialkilasi dalam eter atau pelarut hidrokarbon, misalnya :
PCl3 + 3C6H5MgCl → P(C6H5)3 + 3MgCl2
VOCl3 + 3(CH3)3SiCH2MgCl → VO(CH2SiMe3)3 + 3MgCl2
- Interaksi Hidrida Logam atau nonlogam dengan alkena atau alkuna.
- Reaksi Oksidatif adisi. Reaksi yang dikenal sebagai reaksi Oksa dimana Alkil atau Aril Halida ditambahkan pada senyawa logam transisi Koordinasi tidak jenuh menghasilkan ikatan logam Karbon. Contohnya:
RhCl(PPh3)3 + CH3I → RhClI(CH3)(PPh3)2 + PPh3
- Reaksi Insersi yaitu reaksi yang menghasilkan ikatan-ikatan dengan Karbon, sebagai contoh:
SbCl5 + 2HC CH→Cl3Sb(CH=CHCl)2
- · Ikatan ionik. Ikatan ionik organologam terbentuk dari unsur yang sangat elektropositif yaitu unsur pada golongan I, II, dan III. Organologam dengan yang berikatan secara ionik bersifat tak larut dalam pelarut hidrokarbon dan mudah teroksidasi.
- · Ikatan kovalen. Ikatan kovalen organologam yang mudah menguap terbentuk dari logam Zn, Cd, Hg, dan logam non-transisi gologan III (kecuali aluminium), IV, dan V. Ikatan kovalen ini terbentuk dengan cara memberikan satu elektron tunggalnya, baik dari logam maupun unsur organiknya, untuk dipakai secara bersama. Sifat dari senyawa organologam dengan ikatan kovalen ini mudah menguap, larut dalam pelarut organik, dan tidak larut dalam air.
2. Sejarah Singkat Kimia Organologam
Ada beberapa pendapat dan perdebatan tentang pembuatan senyawa organologam pertama kali, ada pendapat yang menyatakan bahwa cadet , sebagian mengatakan bahwa seize yang pertama.
Uap dari Cairan Cadet 1760
Uap dari Cairan Cadet 1760
As2O3 + 4 CH3COOK –> [AsMe2]2
senyawa organologam pertama yang ditemukan oleh cadet pada tahun 1760. Namun senyawa organometal yang ia hasilkan bukanlah hasil yang diharapkan dari reaksi kalium asetat dan arsen trioksida . oleh karena itulah ada yang tidak setuju dengan pendapat bahwa cadet yang pertama mensintesis senyawa organometal.
Garam Zeize disintesis pada 1827 K[Pt(C2H4)Cl3] • H2O
Zeise menemukan senyawa organometal pertama yang memang disengaja. Setelah itu, Birnbaum mengkorfimasi adanya ligand H2C=CH2 pada1868 yang mendukung penemuan Zeise. Sedangkan pada 1975, struktur sempurna dari garam zeise terkarakterisasi sehingga membuktikan serangkaian penemuan dari terdahulunya
Zeise menemukan senyawa organometal pertama yang memang disengaja. Setelah itu, Birnbaum mengkorfimasi adanya ligand H2C=CH2 pada1868 yang mendukung penemuan Zeise. Sedangkan pada 1975, struktur sempurna dari garam zeise terkarakterisasi sehingga membuktikan serangkaian penemuan dari terdahulunya
Grignard Reagents (XMgR)
Grignard Reagents (XMgR) disintesis sekitar 1900 oleh victor Grignard Secara tak sengaja diproduksi ketika ingin membuat senyawa lain Saytzeff method. Saat itu ia sedang melakukan penelitian dibawah bimbingan dosennya bernama Barbier.
Tahap awal reaksi adalah reaksi pembentukan metil magnesium iodida, reagen Grignard, dari reaksi antara alkil halida (metil iodida dalam contoh di bawah ini) dan magnesium dalam dietil eter kering.
CH3I + Mg –> CH3MgI
Anda pasti melihat bahwa magnisium terikat langsung dengan karbon. Senyawa semacam ini yang sering disebut sebagai reagen Grignard dengan ikatan C-logam dimasukkan dalam golongan senyawa organologam. Ikatan C-logam sangat labil dan mudah menghasilkan karbanion seperti CH3- setelah putusnya ikatan logam-karbon. Ion karbanion cenderung menyerang atom karbon bermuatan positif. Telah dikenal luas bahwa atom karbon gugus aldehida atau gugus keton bermuatan positif karena berikatan dengan atom oksigen yang elektronegatif. Atom karbon ini akan diserang oleh karbanion menghasilkan adduct yang akan menghasilkan alkohol sekunder dari aldehida atau alkohol tersier dari keton setelah hidrolisis.
C6H5CHO + CH3MgI –> C6H5CH(CH3)OMgI
Reaksi Grignard adalah contoh reaksi senyawa organologam. Karena berbagai jenis aldehida dan keton mudah didapat, berbagai senyawa organik dapat disintesis dengan bantuan reaksi Grignard.
1951 – 1952 Penemuan of ferrocene, Fe(h5-C5H5)2
Keally, Pauson, dan Miller melaporkan synthesis ferrocene ini secara tak sengaja, karena sebenarnya mereka ingin mensintesis fulvalen. Yaitu senyawa sandwich hidrokarbon saja.
Ferrocene merupakan struktur yang sangat stabil dengan struktur 2 benzene yang mengapit atom Fe, karena sangat stabil maka penggunaan ferrocene ini sangat banyak. 1973 Nobel prize Geoffrey Wilkinson dan Ernst Otto Fischer karena banyak penelitiannya pada senyawa sandwich (metallocene)
Ziegler/Natta polymerization
1955 Ziegler dan Natta mengembangkan polimerisasi olefin pada tekanan rendah menggunakan campuran katalis logam (transition metal halide / AlR3)
Giulio Natta bekerja pada penelitian bersama Ziegler menerapkan a-olefin yang lain seperti propylene dan styrene pada reaksi polimerisasi. menghasilkan polypropylene dibuat menjadi 2 fraksi: amorphous (atactic) dan crystalline (tactic).pada 1963 Nobel prizeuntuk Karl Ziegler dan Giulio Natta pada katalis Ziegler-Natta yang nantinya digunakan secara komersil dalam pembuatan plastik
Kompleks Vaska
Pada tahun 1962 Kompleks Vaska dilaporkan oleh Lauri Vaska , senyawa ini memiliki kemampuan adisi oksidasi dan dapat mengikat O2 secara reversibel
Penemuan fulleren pada 1985
Fulleren merupakan senyawa karbon yang saling berikatan membentuk suatu bentuk bola yang berongga. Fulleren ini dapat menangkap senyawa logam di dalamnya sehingga disebut juga metallofulleren.
3. Senyawa organometalik dapat dicontohkan pada reaksi reagen Grignard
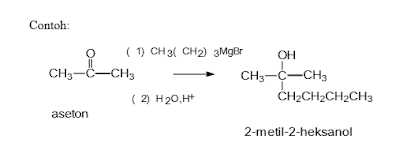
Reaksi Grignard adalah reaksi kimia organologam di mana alkil - atau Aril-magnesium halides (reagen Grignard) menambah gugus karbonil Aldehida atau keton. Reaksi ini adalah alat penting untuk pembentukan ikatan antar karbon. Reaksi Halida organik dengan magnesium bukan reaksi Grignard, tetapi menyediakan peraksi Grignard. Pereaksi Grignard memiliki rumus umum RMgX dimana X adalah sebuah halogen, dan R adalah sebuah gugus alkil atau aril (berdasarkan pada sebuah cincin benzen). Pereaksi Grignard sederhana bisa berupa CH3CH2MgBr.

Pereaksi Grignard memiliki rumus umum RMgX dimana X adalah sebuah halogen, dan R adalah sebuah gugus alkil atau aril (berdasarkan pada sebuah cincin benzen). Pereaksi Grignard sederhana bisa berupa CH3CH2MgBr.
Sebuah contoh dari reaksi grignard:

Reaksi dan pereaksi Grignard ditemukan oleh dan diberi nama sesuai dengan penemunya yaitu kimiawan Perancis François Auguste Victor Grignard (Universitas Nancy, Perancis), yang dianugerahi Nobel Kimia tahun 1912 ini bekerja Grignard reagen mirip dengan menghasilkan reagen karena keduanya nukleofil kuat yang dapat membentuk ikatan antar karbon yang baru.
Reagen Grignard berfungsi sebagai nukleofil, menyerang atom karbon elektrofilik yang hadir dalam ikatan polar gugus karbonil. Penambahan pereaksi Grignard untuk karbonil biasanya hasil melalui keadaan transisi enam-beranggota cincin.
Mekanisme dari reaksi Grignard:


Namun, dengan pereaksi Grignard terhalang, reaksi dapat melanjutkan dengan transfer elektron tunggal. Jalur serupa diasumsikan untuk reaksi lain dari reagen Grignard, misalnya, dalam pembentukan ikatan antara karbon-fosfor, timah-karbon, karbon-silikon, boron-karbon dan karbon-heteroatom.
4. Reaksi-Reaksi dari pereaksi Grignard
Reaksi pereaksi Grignard dengan senyawa-senyawa karbonil. Reaksi antara berbagai macam senyawa karbonil dengan pereaksi Grignard bisa terlihat sedikit rumit, walaupun pada kenyataannya semua senyawa karbonil bereaksi dengan cara yang sama – yang berbeda hanyalah gugus-gugus yang terikat pada ikatan rangkap C=O.
Reaksi Dengan senyawa karbonil

Apa yang terjadi pada reaksi ini jauh lebih mudah dipahami dengan mencermati persamaan umumnya (menggunakan gugus "R" bukan gugus tertentu) – setelah anda memahami dengan gugus R barulah bisa diganti dengan gugus yang sesungguhnya jika diperlukan.
Reaksi-reaksi yang terjadi pada dasarnya sama untuk reaksi dengan karbon dioksida – yang membedakan hanya sifat-sifat produk organiknya.
Pada tahap pertama, pereaksi Grignard diadisi ke ikatan rangkap C=O:
Asam encer selanjutnya ditambahkan untuk menghidrolisisnya. (Pada persamaan berikut digunakan persamaan umum dengan tidak mempertimbangkan fakta bahwa Mg(OH)Br akan bereaksi lebih lanjut dengan asam yang ditambahkan.)
Alkohol terbentuk. Salah satu kegunaan penting dari pereaksi Grignard adalah kemampuannya untuk membuat alkohol-alkohol kompleks dengan mudah. Jenis alkohol yang dihasilkan tergantung pada senyawa karbonil yang digunakan – dengan kata lain, gugus R dan R’ yang dimiliki.
Reaksi yang paling sering dengan keton atau aldehida

Reaksi dengan senyawa elektrofilik lainnya

Reaksi Oksidasi

B. Reaksi Organologam
1. Insertion Reaction
Reaksi penyisipan merupakan suatu reaksi yang menyisipkan suatu molekul kedalam suatu senyawa organologam. Molekul yang menyisip kedalam senyawa organologam ini dapat bertindak sebagai 1,1 insertion dan 1,2 insertion, kedua hal ini merupakan suatu acuan bagaimana molekul ini menyisipkan dirinya diantara logam dan ligan senyawa organologam yaitu apakah menggunakan satu atom untuk mengikat logam dan ligan (1,1 insertion) atau molekul tersebut mempunyai dua atom yang satu mengikat logam sedangkan atom lain mengikat ligan (1,2 insertion). Contoh reaksi insertion dapat ditunjukan dari siklus reaksi dibawah ini (reaksi penyisipan di dalam kotak).
Pada reaksi diatas dapat dijelaskan bahwa senyawa HNi(CO)2Cl direaksikan dengan senyawa RCH=CH2 maka senyawa RCH=CH2 akan menyisip diantara logam dengan atom H. Reaksi ini merupakan 1,2 insertion, dimana ada dua atom C pada senyawa ini, satu atom C mengikat logam Ni dan atom C yang lain mengikat H, akibatnya ikatan rangkap pada molekul RCH=CH2 berubah menjadi tunggal karena elektronnya dipakai untuk mengikat logam dan atom H.
2. Carbonyl Insertion (Alkyl Migration)
Reaksi penyisipan karbonil pada dasarnya sama seperti penyisipan biasanya (1,1 insertion dan 1,2 insertion), tetapi yang membedakan disini adalah yang masuk diantara logam dan ligan adalah molekul karbonil (CO). Mekanisme reaksi dari penyisipan karbonil diusulkan ada tiga, yaitu penyisipan secara langsung, migrasi karbonil, dan migrasi alkil. Dari ketiga usulan mekanisme reaksi ini, dilakukan pengujian melalui eksperimental. Hasilnya mekanisme penyisipan karbonil yang diterima atau sesuai hasil pengujian adalah migrasi alkil. Jadi alkil bermigrasi dan terikat pada karbonil, tempat yang ditinggalkan alkil tadi ditempati karbonil dari luar. Dapat dijelaskan bahwa reaksi penyisipan karbonil seperti dijelaskan pada pengantar singkat reaksi penyisipan karbonil diatas, mekanisme reaksinya adalah migrasi alkil. Pada gambar diatas ditunjukkan bahwa CH2CH2R bermigrasi ke CO, tempat kosong pada logam yang ditinggalkan alkil tersebut selanjutnya diisi oleh CO dari luar.
3. Hydride Elimination
Reaksi eliminasi hidrida ini yang sering ditemui adalah reaksi β-elimination yang merupakan suatu reaksi transfer atom H pada suatu ligan alkil (pada ligan posisi β terhadap logam) ke logam. Reaksi ini dapat menyebabkan meningkatnya bilangan oksidasi dan bilangan koordinasi dari logam. Proses transfer atom H pada alkil posisi β ini terjadi apabila posisi logam, carbon α, karbon β, dan hidrida koplanar. Contoh reaksi ini adalah pada siklus Wacker. Pada siklus ini terdapat reaksi β-hibrid-eliminasi (dalam kotak).
Pada reaksi diatas dinamakan reaksi β-hidrid-eliminasi karena pada molekul A, atom H yang terikat pada atom O (pada gugus OH posisi β terhadap logam), ditransfer menuju ke logam Pd. Pada contoh reaksi ini ternyata reaksi β-hidrid-eliminasi tidak hanya atom H milik alkil posisi β, tetapi dapat juga dari atom H dari gugus hidroksil (OH) pada posisi β. Atom H yang ditransfer ke logam Pd menyebabkan bilangan koordinasi logam Pd bertambah dari dua menjadi tiga. Hasil akhir dari reaksi ini adalah terbentuknya molekul B.
4. Abstraction Reaction
Reaksi abstraksi merupakan suatu reaksi eliminasi ligan yang tidak akan merubah bilangan koordinasi logam. Reaksi ini berkaitan dengan pembuangan substituent pada ligan dengan posisi karbon α dan β terhadap logam. Pembuangan substituent pada ligan ini dapat terjadi karena pengaruh suatu reagen eksternal. Contoh dari reaksi ini adalah:
Pada reaksi diatas (dalam kotak) disebut sebagai reaksi abstraksi dikarenakan terjadi pembuangan substituent yaitu atom H pada ligan η4-5-exo-RC5H5 (tetrahapto) yang disebabkan oleh reagen Ph3CPF6. Dari hasil pembuangan atom H ini, maka ligan η4-5-exo-RC5H5 berubah menjadi η5-RC5H4. Bilangan koordinasi logam pada reaksi ini tidak berubah, tetapi bilangan oksidasi logam Fe berubah dari Fe(0) menjadi Fe(II).
Berikut ini akan dijelskan lebih lanjut mengenai reaksi-reaksi yang terjadi pada senyawa Organometalik, yaitu sebagai berikut :
a. Konsep dasar Organometalik dan Reaksi-reaksi Pembentukan Organometalik
Pada dasarnya Organometalik prinsipnya yaitu atom-atom Karbon dari gugus organik terikat kepada atom logam. Konsep ini yang mendasari Organometalik, sehingga banyak cara untuk menghasilkan ikatan-ikatan logam pada Karbon yang berguna bagi kedua logam transisi dan non-transisi. Reaksi-reaksi pembentukan organometalik, yaitu sebagai berikut :
1. Reaksi Logam Langusng
Pada dasarnya Reaksi Logam Langsung merupakan suatu sintesis yang paling awal oleh ahli kimia Inggris, Frankland dalam tahun 1845 adalah interaksi antara Zn dan suatu alkil Halida. Adapun yang lebih berguna adalah penemuan ahli kimia Perancis, Grignard yang dikenal sebagai pereaksi Grignard. Contohnya interaksi Magnesium dan alkil atau aril Halida dalam eter, yaitu sebagai beikut :
Mg + CH3I → CH3MgI
Selain Mg Reaksi Logam Langsung para pembentukan Organologam juga terjadi pada alkil atau aril Halida juga terjadi dengan Li, Na, K, Ca, Zn dan Cd. Beirkut ini akan dijelaskan lebih lanjut mengenai Pereaksi Grignard pada Senyawa Organometalik, yaitu sebagai berikut :
Reagensia (pereaksi) Grignard adalah produk reaksi radikal bebas antara logam magnesium dan suatu senyawa organohalogen dalam suatu pelarut eter. Yang termasuk Reagensia Grignard adalah organomagnesium halida (RMgX). Seperti yang telah dijelaskan diatas contoh dari reaksi Grignard, berikut ini yaitu bentuk umum dari reaksi Grignard, yaitu sebagai berikut :
Reaksi bersifat umum dan tidak terlalu bergantung pada sifat gugus R. alkil halida primer, sekunder, dan tersier, serta alilik dan benzilik semuanya membentuk reagensia Grignard. Alkil fluorida tidak bereaksi dengan magnesium dalam eter. Alkil klorida cenderung bereaksi dengan lambat, dan aril halida tidak bereaksi. Alkil bromida dan alkil iodida keduanya dengan cepat bereaksi dengan magnesium, tapi bro omida lebih sering digunakan karena lebih murah dan mudah diperoleh.
- Penggunaan Zat Pengalkilasi
Pada dasarnya senyawa ini dimanfaatkan untuk membuat senyawa organometalik lainnya. Kebanyakan Halida nonlogam dan logam atau turunan Halida dapat dialkilasi dalam eter atau pelarut hidrokarbon, misalnya perhatikan contoh dibawah ini :
PCl3 + 3C6H5MgCl → P(C6H5)3 + 3MgCl2
VOCl3 + 3(CH3)3SiCH2MgCl → VO(CH2SiMe3)3 + 3MgCl2
- Interaksi Hidrida Logam atau Nonlogam dengan Alkena atau Alkuna
Reaksi dari interaksi hidrida logam atau nonlogam dengan alkena atau alkuna ini dapat dicontohkan sebagai berikut :
1/2B2H6 + 3 C= C → B - (C = C)3
- Reaksi Oksidatif Adisi
Pada reaksi olsidatif adisi yang dikenal sebagai reaksi Oksa.Reaksi ini terjadi dimana Alkil atau Aril Halida ditambahkan pada senyawa logam transisi Koordinasi tidak jenuh menghasilkan ikatan logam Karbon. Contohnya :
RhCl(PPh3)3 + CH3I → RhClI(CH3)(PPh3)2 + PPh3
- Reaksi Insersi
Pada dasarnya reaksi Inerisasi ini yaitu reaksi penyisipan. Dimana pada reaksi ini akan menghasilkan ikatan-ikatan dengan Karbon, sebagai contoh:
SbCl5 + 2HC CH → Cl3Sb(CH = CHCl)2
Atom pusat dari suatu senyawa kompleks yang digunakan antara lain logam-logam transisi deret pertama seperti: Cr, Mn, Fe, Co, Ni, Cu, dan Zn (HIjazi et al, 2008). Ligan dari suatu senyawa komplek dapat mempengaruhi bentuk geometri dari senyawa organometalik itu sendiri sehingga dapat dimanfaatkan dalam berbagai reaksi kimia. Tabel dibawah ini akan menjelaskan tentang perbedaan jenis ligan yang terikat pada atom pusat, dimana memberikan bentuk geometri yang berbeda dan perbedaan reaksi yang mampu dikatalisisnya.
Senyawa komplek organometalik dengan perbedaan ligan, geometri, dan reaksi yang dapat dikatalisisnya (Blaser et al, 2000).
Metal oxidation state
|
Example
|
Geometry
|
Preferred reaction
|
Ni0
|
Ni(CO4)
|
Tetrahedral
|
Ligan dissociation
|
Pd0
|
Pd(PR3)2
|
Linear
|
Oxidative addition
|
NiII Pd II
|
ArPd(PR3)2X
|
Square planar
|
Reductive elimination
|
RhI Ir I
|
Rh(PR3)3X2
|
Square planar
|
Oxidative addition
|
Ru II
|
Ru(PR3)3X2
|
Trigonal pyramid l
|
Ligan dissociation
Oxidative addition
|
Ru II Rh III
|
Rh(Pr3)3XH2
|
Octahedral
|
Reductive elimination
|
Ir III
|
b. Tata Nama Senyawa Organomrtalik
1. Di beri nama sebagai alkil logam (satu kata)
Contoh: CH3 – CH2 – CH2 – Li (n-propalium)
(CH3CH2)4Pb (tetratimbal)
2. Jika logam terdapat pada anion organik atau suatu karbon, maka diberi nama sebagai turunan anorganiknya
Contoh: CH3 – MgBr (metilmagnesium bromida)
Ph – HgBr (fenilmerkuri klorida)
3. Senyawa silikon dan beberapa metaloid lain di beri nama sebagai turunan (derivat) hidridanya dengan satu suku kata.
Contoh: SiH4 (silana)
(CH3)2SiH2 (dimetilsilana)
c. Jenis Ikatan pada Senyawa Organometalik
Pada dasarnya ada 2 jenis ikatan yang terjadi pada Senyawa Organometalik, yaitu ikatan Ionik dan ikatan Kovalen, yaitu akan dijelaskan sebagai berikut :
a. Ikatan Ionik
Ikatan Ionik merupakan ikatan yang terbentuk dari unsur yang sangat elektropositif. yaitu unsur pada golongan I, II, dan III. Organometalik dengan yang berikatan secara ionik bersifat tak larut dalam pelarut hidrokarbon dan mudah teroksidasi. Kestabilan dan kereaktifan senyawaan ionik ditentukan dalam satu bagian oleh kestabilan ion karbon. Garam logam ion-ion karbon yang kestabilannya diperkuat oleh delokalisasi elektron lebih stabil walaupun masih relatif reaktif.
b. Ikatan Kovelen
Ikatan kovalen organometalik yang mudah menguap terbentuk dari logam Zn, Cd, Hg, dan logam non-transisi gologan III (kecuali aluminium), IV, dan V. Ikatan kovalen ini terbentuk dengan cara memberikan satu elektron tunggalnya, baik dari logam maupun unsur organiknya, untuk dipakai secara bersama. Sifat dari senyawa organometalik dengan ikatan kovalen ini mudah menguap, larut dalam pelarut organik, dan tidak larut dalam air.
d. Reaktifitas Reagensia Grignard
Dalam kebanyakan senyawa organik. Karbon tidak mengemban muatan parsial apapun atau mengemban muatan positif parsial. Dalam suasana reagensia Grignard karbon terikat pada suatu unsur elektropositif, dan karena itu mengemban suatu parsial negatif.
Karbon dengan muatan parsial negatif (karena Mg elektropositif), karbon ini mempunyai karakter seperti karbanion.
e. Reaksi yang Melibatkan Reagensia Grignard
Reaksi terpenting Reagensia Grignard ialah reaksi dengan senyawa karbonil. Dalam suatu karbonil (C =O) elektron dalam ikatan karbon-oksigen ditarik kearah oksigen yang elektronegatif. Karbon gugus karbonil, yang mempunyai muatan positif parsial, diserang oleh karbon reagensia Grignard yang nukleofilik itu. Reaksi yang melibatkan reagensia Grignard akan dijelaskan dbawah sebagai berikut :
a. Reaksi RMgX dengan Keton
Bila garam tersebut diolah dengan air atau asam dalam air akan menghasilkan alkohol tersier.
d. Reaksi RMgX dengan Karbon Dioksida
f. Jenis-jenis Senyawa Organometalik
Berikut ini akan dijelaskan mengenai jenis-jenis dari Senyawa Oranometalik, yaitu sebagai berikut :
a. Senyawa Organotimah
Senyawa organotimah adalah senyawa organometalik yang disusun oleh satu atau lebih ikatan antara atom timah dengan atom karbon (Sn-C). Senyawaan organotimah cenderung memiliki karakter satu atau lebih ikatan kovalen antara timah dan karbon. Metode Grignard, metode ini merupakan metode pertama yang dilakukan di USA dan Eropa Barat dalam memproduksi senyawaan organotimah. Metode ini memerlukan kondisi reaksi yang inert, jauh dari nyala api secara langsung, dan bersifat in situ.
1. Metode Wurst, persamaan reaksinya dituliskan sebagai berikut :
2. Metode dengan menggunakan reagen alkil aluminium, metode ini mulai dikenal pada awal tahun 1960-an. Adapun persamaan reaksinya dituliskan sebagai berikut:
b. Logam Transisi
1. Alkil dan Aril Litium (Organolitium
Senyawa Organolitium adalah senyawa Logam Alkali yang mempunyai sifat kelarutan dalam Hidrokarbon atau cairan nonpolar dan penguapan yang tinggi serta mempunyai sifat khas zat Kovalen. . Penggabungan Molekular adalah suatu keistimewaan yang penting dari alkil baik dalam kristal maupun larutan. Jadi dalam Metil lithium atom-atom Li terletak pada sudut-sudut sebuah tetrahedron dengan gugus alkil berpusat pada bidang dihadapannya. Gugus CH3 secara simetris terikat pada tiga atom Li, dan ikatan jembatan alkil ini adalah dari jenis tuna elektron berpusat banyak.
2. Senyawa Organo-Natrium dan Kalium
Semua senyawa ini benar-benar ionik dan tidak larut sampai batas apa pun dalam hidrokarbon karena sangat reaktif, peka terhadap udara, dan terhidrolisis kuat dalam air. Yang terpenting adalah senyawa natrium dari hidrokarbon asam seperti siklopentadiena, idena, asitilena, dan sejenisnya. Ini diperoleh dari interaksi dengan logam natrium atau natrium yang dihamburkan dalam tetrahidrofuran atau dimetilformamida.
3. Magnesium
Pada dasarnya senyawa organik dari Ca,Sr, dan Ba sangat ionik dan relatif tidak berguna, namun senyawa magnesium mungkin adalah yang dipakai paling lias sebagai senyawa organik yang digunakan sangat luas dalam kimia organik dan dalam sintesis senyawa alkil dan aril dari unsur-unsur lain. Senyawa ini adalah jenis RMgX (pereaksi Grignard) dan MgR2. Yang pertama dibuat dengan interaksi langsung logam dengan suatu halida organik RX dalam suatu pelarut yang cocok, biasanya suatu eter seperti dietil eter atau tetrahidrofuran. Reaksinya biasanya paling cepat dalam iodida, RI, dan iod dapat digunakan sebagai suatu pengionisasi. Pereaksi RMgX digunakan in situ. Spesies MgR2 paling baik dibuat dengan reaksi kering.
1. Pada dasarnya ada beberapa senyawa organologam yang tidak berikatan langsung dengan atom karbon seperti pada kompleks Phospine, logam hidrida, organosilikon, organoboron dan sebagainya. Permasalahnnya adalah mengapa hal demikian dapat terjadi ? dan juga jelaskan faktor apa yang mempengaruhinya ?
2. Tolong jelaskan keterkaitan pereaksi Grignard dengan senyawa organometalik ?













Sore saudari kina
ReplyDeleteSaya akan menjawab permasalaham kedua
Senyawa organometalik dapat dicontohkan pada reaksi reagen Grignard.
Reaksi Grignard adalah reaksi kimia organologam di mana alkil - atau Aril-magnesium halides (reagen Grignard) menambah gugus karbonil Aldehida atau keton. Reaksi ini adalah alat penting untuk pembentukan ikatan antar karbon. Reaksi Halida organik dengan magnesium bukan reaksi Grignard, tetapi menyediakan peraksi Grignard. Pereaksi Grignard memiliki rumus umum RMgX dimana X adalah sebuah halogen, dan R adalah sebuah gugus alkil atau aril (berdasarkan pada sebuah cincin benzen). Pereaksi Grignard sederhana bisa berupa CH3CH2MgBr
Saya akan mencoba menjawab permasalahan No.3 Pada dasarnya ada beberapa senyawa organologam yang tidak berikatan langsung dengan atom karbon. Mengapa hal demikian dapat terjadi ? Karena gugus organiknya terikat pada Ti melalui atom oksigen. Sedangkan (C6H5) Ti (OC3H7)3 adalah senyawa organologam karena terdapat satu ikatan langsung antara karbon C dari gugus fenil dengan logam Ti.
ReplyDeleteDari bentuk ikatan pada senyawa organologam, senyawa ini dapat dikatakan sebagai jembatan antara kimia organik dan anorganik.
baikalah saya akan menjawab permasalahan no 1:
ReplyDeleteSenyawa organologam adalah senyawa di mana atom-atom karbon dari gugus organik terikat kepada atom logam. Contoh, suatu aloksida seperti (C3H7O)4Ti tidaklah dianggap sebagai suatu senyawa organologam karena gugus organiknya terikat pada Ti melalui oksigen, sedangkan C6H5Ti(OC3H7)3 karena terdapat satu ikatan langsung antara karbon C dari gugus fenil dengan logam Ti.HH Istilah organologam biasanya didefenisikan agak longgar, dan senyawaan dari unsur-unsur seperti Boron, fosfor, dan silikon semuanya mirip logam. Tetapi untuk senyawa yang mengandung ikatan antara atom logam dengan oksigen, belerang, nitrogen, ataupun dengan suatu halogen tidak termasuk sebagai senyawa organologam. Dari bentuk ikatan pada senyawa organologam, senyawa ini dapat dikatakan sebagai jembatan antara kimia organik dan anorganik.
Saya akan menjawab permasalahan yg terakhir Pereaksi Grignard berfungsi sebagai nukleofil, menyerang atom karbon elektrofil yang terdapat dalam ikatan polar gugus karbonil. Penambahan pereaksi Grignard pada karbonil biasanya berlangsung melalui suatu kondisi transisi cincin enam.[7]
ReplyDeleteMekanisme reaksi Grignard.
Namun, tanpa pereaksi Grignard, reaksi dapat berlangsung dengan transfer elektron tunggal. Jalur serupa diasumsikan untuk reaksi lain pereaksi Grignard, contohnya, dalam pembentukan ikatan karbon–fosforus, karbon–timah, karbon–silikon, karbon–boron dan karbon–heteroatom lainnya.
Saya akan mencoba menjawab permasalahan No.3 Pada dasarnya ada beberapa senyawa organologam yang tidak berikatan langsung dengan atom karbon. Mengapa hal demikian dapat terjadi ? Karena gugus organiknya terikat pada Ti melalui atom oksigen. Sedangkan (C6H5) Ti (OC3H7)3 adalah senyawa organologam karena terdapat satu ikatan langsung antara karbon C dari gugus fenil dengan logam Ti.
ReplyDeleteDari bentuk ikatan pada senyawa organologam, senyawa ini dapat dikatakan sebagai jembatan antara kimia organik dan anorganik.
Saya akan menjawab permasalaham kedua
ReplyDeleteSenyawa organometalik dapat dicontohkan pada reaksi reagen Grignard.
Reaksi Grignard adalah reaksi kimia organologam di mana alkil - atau Aril-magnesium halides (reagen Grignard) menambah gugus karbonil Aldehida atau keton. Reaksi ini adalah alat penting untuk pembentukan ikatan antar karbon.
Saya akan mencoba menjawab permasalahan Anda yg ke-3:
ReplyDeletePada dasarnya ada beberapa senyawa organologam yang tidak berikatan langsung dengan atom karbon. Mengapa hal demikian dapat terjadi ? Karena gugus organiknya terikat pada Ti melalui atom oksigen. Sedangkan (C6H5) Ti (OC3H7)3 adalah senyawa organologam karena terdapat satu ikatan langsung antara karbon C dari gugus fenil dengan logam Ti.
permasalahan No.3 Pada dasarnya ada beberapa senyawa organologam yang tidak berikatan langsung dengan atom karbon. Mengapa hal demikian dapat terjadi ? Karena gugus organiknya terikat pada Ti melalui atom oksigen. Sedangkan (C6H5) Ti (OC3H7)3 adalah senyawa organologam karena terdapat satu ikatan langsung antara karbon C dari gugus fenil dengan logam Ti.
ReplyDeleteSore saudari kina
ReplyDeleteSaya akan menjawab permasalaham kedua
Senyawa organometalik dapat dicontohkan pada reaksi reagen Grignard.
Reaksi Grignard adalah reaksi kimia organologam di mana alkil - atau Aril-magnesium halides (reagen Grignard) menambah gugus karbonil Aldehida atau keton. Reaksi ini adalah alat penting untuk pembentukan ikatan antar karbon. Reaksi Halida organik dengan magnesium bukan reaksi Grignard, tetapi menyediakan peraksi Grignard. Pereaksi Grignard memiliki rumus umum RMgX dimana X adalah sebuah halogen, dan R adalah sebuah gugus alkil atau aril (berdasarkan pada sebuah cincin benzen). Pereaksi Grignard sederhana bisa berupa CH3CH2MgBr
Nomor 3.
ReplyDeletePada dasarnya ada beberapa senyawa organologam yang tidak berikatan langsung dengan atom karbon. Mengapa hal demikian dapat terjadi ? Karena gugus organiknya terikat pada Ti melalui atom oksigen. Sedangkan (C6H5) Ti (OC3H7)3 adalah senyawa organologam karena terdapat satu ikatan langsung antara karbon C dari gugus fenil dengan logam Ti.
ReplyDeleteSaya akan mencoba menjawab permasalahan No.3 Pada dasarnya ada beberapa senyawa organologam yang tidak berikatan langsung dengan atom karbon. Mengapa hal demikian dapat terjadi ? Karena gugus organiknya terikat pada Ti melalui atom oksigen. Sedangkan (C6H5) Ti (OC3H7)3 adalah senyawa organologam karena terdapat satu ikatan langsung antara karbon C dari gugus fenil dengan logam Ti.
Dari bentuk ikatan pada senyawa organologam, senyawa ini dapat dikatakan sebagai jembatan antara kimia organik dan anorganik.
REPLY
No 2 Reaksi Grignard adalah reaksi kimia organologam di mana alkil - atau Aril-magnesium halides (reagen Grignard) menambah gugus karbonil Aldehida atau keton. Reaksi ini adalah alat penting untuk pembentukan ikatan antar karbon. Reaksi Halida organik dengan magnesium bukan reaksi Grignard, tetapi menyediakan peraksi Grignard. Pereaksi Grignard memiliki rumus umum RMgX dimana X adalah sebuah halogen, dan R adalah sebuah gugus alkil atau aril (berdasarkan pada sebuah cincin benzen). Pereaksi Grignard sederhana bisa berupa CH3CH2MgBr
ReplyDeleteSaya akan mencoba menjawab permasalahan No.3 Pada dasarnya ada beberapa senyawa organologam yang tidak berikatan langsung dengan atom karbon. Mengapa hal demikian dapat terjadi ? Karena gugus organiknya terikat pada Ti melalui atom oksigen. Sedangkan (C6H5) Ti (OC3H7)3 adalah senyawa organologam karena terdapat satu ikatan langsung antara karbon C dari gugus fenil dengan logam Ti.
ReplyDeleteDari bentuk ikatan pada senyawa organologam, senyawa ini dapat dikatakan sebagai jembatan antara kimia organik dan anorganik.
jawaban no 1
ReplyDeleteReaksi penyisipan merupakan suatu reaksi yang menyisipkan suatu molekul kedalam suatu senyawa organologam. Molekul yang menyisip kedalam senyawa organologam ini dapat bertindak sebagai 1,1 insertion dan 1,2 insertion, kedua hal ini merupakan suatu acuan bagaimana molekul ini menyisipkan dirinya diantara logam dan ligan senyawa organologam yaitu apakah menggunakan satu atom untuk mengikat logam dan ligan (1,1 insertion) atau molekul tersebut mempunyai dua atom yang satu mengikat logam sedangkan atom lain mengikat ligan (1,2 insertion). Contoh reaksi insertion dapat ditunjukan dari siklus reaksi dibawah ini (reaksi penyisipan di dalam kotak).
Pada reaksi diatas dapat dijelaskan bahwa senyawa HNi(CO)2Cl direaksikan dengan senyawa RCH=CH2 maka senyawa RCH=CH2 akan menyisip diantara logam dengan atom H. Reaksi ini merupakan 1,2 insertion, dimana ada dua atom C pada senyawa ini, satu atom C mengikat logam Ni dan atom C yang lain mengikat H, akibatnya ikatan rangkap pada molekul RCH=CH2 berubah menjadi tunggal karena elektronnya dipakai untuk mengikat logam dan atom H.